Nat Ecol Evol | 武汉大学赵华斌教授团队揭示了菊头蝠科
蝙蝠的染色体演化及其免疫适应机制
近日,武汉大学赵华斌团队在Nature子刊Nature Ecology & Evolution上在线发表了题为“Comparative genomics provides insights into chromosomal evolution and immunological adaptation in horseshoe bats(比较基因组学为菊头蝠科蝙蝠的染色体演化和免疫适应提供了见解)”的研究论文(图1)。该研究结合比较基因组学、群体基因组学、比较转录组学等分析,以及细胞水平的功能实验,提出了基因组大片段重复(Segmental Duplication, SD)促进菊头蝠染色体重排的假说,并揭示了菊头蝠独特的免疫适应性机制。
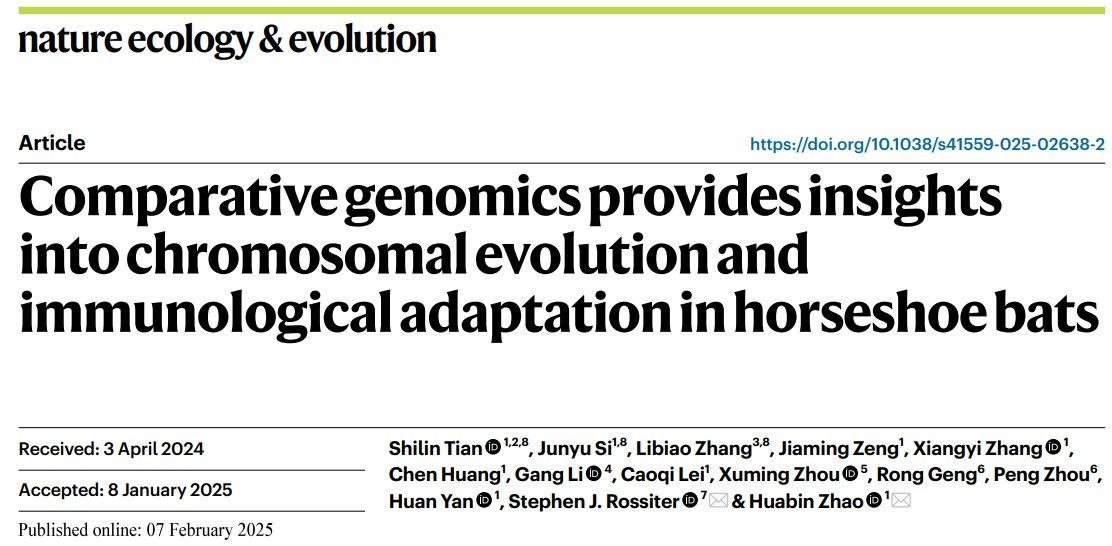
图1. 相关论文在线发表于Nat Ecol Evol.
蝙蝠能够无症状地携带多种哺乳动物烈性病毒,包括多次引起全球大流行的冠状病毒;在所有蝙蝠的科级分类群中,菊头蝠科的冠状病毒检测频率最高。因此,研究菊头蝠的免疫适应机制可以为疫源动物抗病毒免疫的分子演化机制提供新见解,对人类制定抗病毒治疗策略具有参考价值。
首先,研究人员应用了团队之前开发的改良四步法基因组组装策略(Tian et al., 2023, Sci Adv),生成了2种菊头蝠(皮氏菊头蝠R. pearsonii 和中华菊头蝠R. sinicus)和3个近缘种(包括两种蹄蝠:大蹄蝠Hipposideros armiger和普氏蹄蝠H. pratti,以及1种假吸血蝠:印度假吸血蝠Megaderma lyra)的染色体水平的高质量基因组。结合已发表的2种菊头蝠的染色体水平的基因组(马铁菊头蝠R. ferrumequinum、中菊头蝠R. affinis),通过比较基因组学方法,分析了菊头蝠物种分化过程中的染色体重排:推测出菊头蝠祖先有30对染色体,鉴定出属于非洲-古北区演化枝的马铁菊头蝠的基因组结构与菊头蝠祖先最相似、属于亚洲演化枝的3种菊头蝠基因组(中华、皮氏和中菊头蝠)发生了2次染色体分裂、在中华菊头蝠中又发生了2次染色体融合(图2a)。有趣的是,在中华菊头蝠的2次染色体融合区中检测到了染色体内超长的大片段重复(SD)(~51 Kb)和较长的SD(~18 Kb)(图2b)。因此,研究团队提出假说:SD可能促进了菊头蝠的染色体重排,进而在菊头蝠科的物种多样性分化中发挥了重要作用(图2c)。
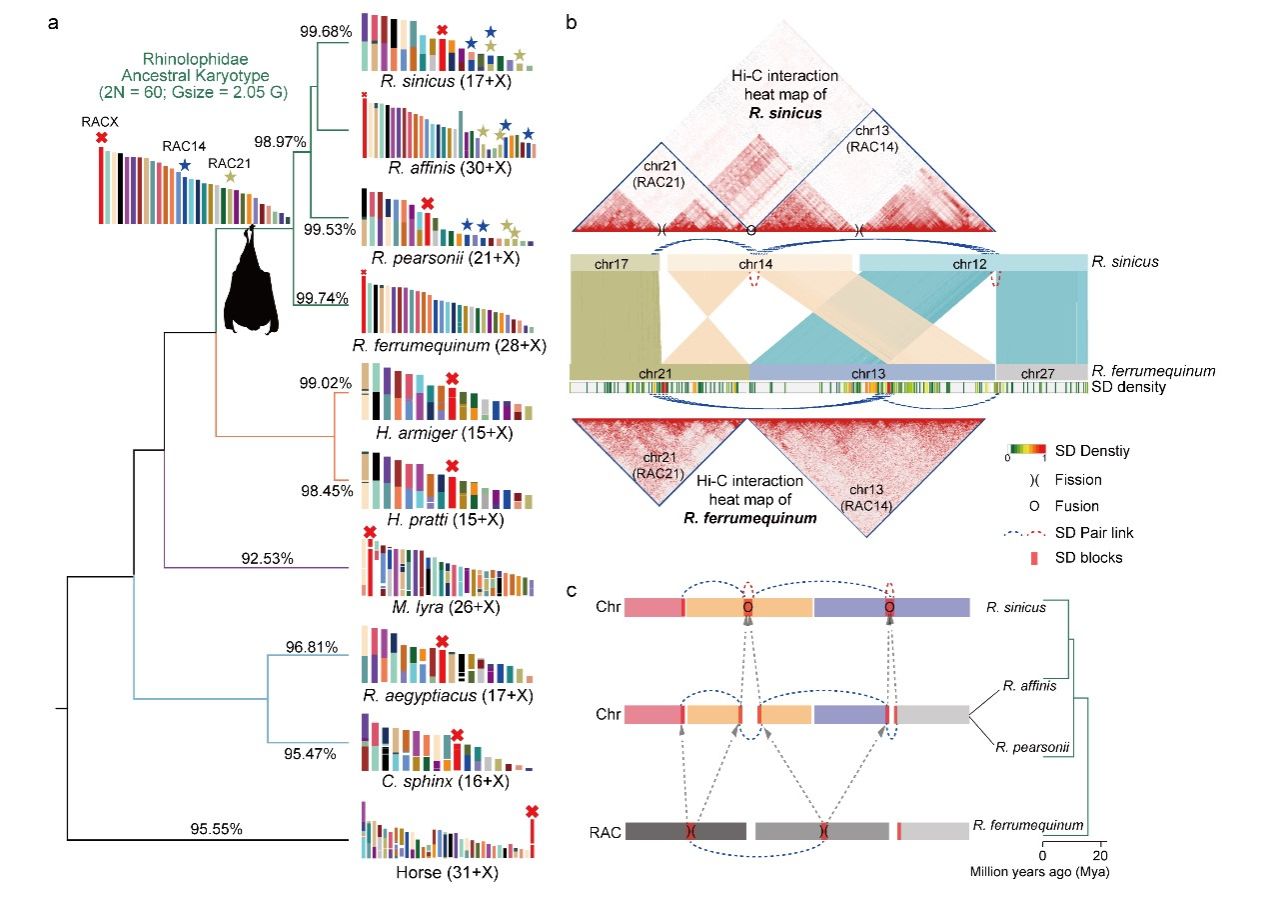
图2. 菊头蝠科蝙蝠染色体的演化
随后,研究团队发现了SD促进了菊头蝠干扰素刺激基因ANXA2R和I型干扰素(IFN-δ 和IFN-ω)的适应性扩张(图3a)。因为菊头蝠基因组中含有拷贝数最多的ANXA2R完整序列,为了评估ANXA2R扩张是否可能带来增强的抗病毒状态,团队通过检测SARS-CoV-2 GFP/ΔN假病毒粒子在Caco-2-N(表达SARS-CoV-2 N蛋白)细胞系中的复制情况。结果显示,当人或中菊头蝠ANXA2R表达量升高时,含有SARS-CoV-2 GPF/ΔN病毒的细胞更少(图3b),提示ANXA2R的拷贝数增加可能起到抑制病毒复制的作用。另外,在菊头蝠基因组中,I型干扰素亚家族IFN-δ和IFN-ω扩张,而IFN-α收缩,这与其它脊椎动物截然不同(图3c)。结合I型干扰素(IFN-α、IFN-δ和IFN-ω)诱导RfKT细胞(永生化的马铁菊头蝠肾细胞)后产生的转录组功能数据的分析结果,发现菊头蝠IFN-δ的抗病毒活性最强,IFN-ω次之,IFN-α最弱,提示菊头蝠中IFN-δ和IFN-ω亚家族的扩张可能是一种功能补偿机制(图3d)。
图3. 菊头蝠科蝙蝠ANXA2R基因扩增和I型干扰素基因的多样性
最后,研究团队发现了菊头蝠祖先分支上正选择和快速演化的基因与蝙蝠人畜共患病相关的致病病毒密切相关。比如,菊头蝠C5aR1的E199Q/K突变可能改变补体级联的配体结合亲和力,从而减弱对病毒的炎症反应;团队还发现了8个编码病毒受体的基因具有正选择或加速演化信号,其中包括了SARS-CoV和SARS-CoV-2病毒的受体基因ACE2。结合本研究中新产生的来自10个菊头蝠物种的91个基因组测序数据,根据16个已知与SARS-CoV-2的受体结合域(RBD)直接相互作用的位点,鉴定出了30个ACE2单倍型,其中21个(70%)以前未报道过。通过设计细胞功能实验检测了不同的ACE2突变体对SARS-CoV-2的RBD亲和力及其假病毒的进入效率,结果表明菊头蝠物种之间以及物种内不同个体对SARS-CoV-2的易感性存在显著差异。研究团队还报道了与冠状病毒结合相关的突变Y41H和N82D在菊头蝠物种之间发生了趋同演化的证据;发现了马来菊头蝠(R. malayanus)和菲菊头蝠(R. pusillus)都具有促进SARS-CoV-2结合和感染的ACE2突变体,而这两个物种之前被报道携带的冠状病毒与SARS-CoV-2具有最接近的RBD序列相似性。
武汉大学生命科学学院博士毕业生田仕林和司竣宇、广东省科学院动物研究所张礼标研究员为该论文的共同第一作者,武汉大学生命科学学院赵华斌教授和英国伦敦玛丽女王大学Stephen Rossiter教授为论文的共同通讯作者。该研究得到了国家自然科学基金(32270436、32471689)、国家重点研发计划(2021YFF0702004)、广州国家实验室研发计划(SRPG22-001)等项目的资助。
论文链接:
https://www.nature.com/articles/s41559-025-02638-2
专家点评:
点评专家:Lin-Fa Wang(杜克-新加坡国立大学医学院教授,澳大利亚科学院院士)
在过去的三十年里,由蝙蝠携带的病毒引发了多次人畜共患疾病的爆发,其中包括亨德拉病毒、尼帕病毒、SARS病毒、马尔堡病毒、埃博拉病毒、MERS病毒和新冠病毒等。仍有几个重要的科学问题尚未得到充分解答:1)为什么蝙蝠是致命人畜共患病毒的良好宿主?2)蝙蝠携带如此多种病毒,却仍能保持健康的机制是什么?3)不同种类的蝙蝠之间是否存在关键差异,以解释为什么类SARS病毒主要在菊头蝠中被发现?本研究在一定程度上回答了上述3个问题,为该研究领域的知识体系提供了重要补充和进展。最值得关注的是,这是第一个尝试解答第3个问题的研究。
“For the last three decades, there have been multiple zoonotic disease outbreaks caused by bat-borne viruses, including Hendra, Nipah, SARS, Marburg, Ebola, MERS and COVID, among others.” Says Lin-Fa Wang, a Professor at Duke-NUS Medical School (Singapore) and Fellow of Australian Academy of Sciences, one of the world’s leading experts in zoonotic diseases, bat immunology and pathogen discovery. “There are several important research questions yet to be fully addressed: 1) Why are bats such a good reservoir for deadly zoonotic viruses? 2) How can bats maintain healthy despite carrying so many different viruses? 3) Are there any key differences among different bats to explain the observation that SARS-like viruses are mainly found in horseshoe bats? The current study partially addressed all three questions and is an important addition and advance to the current knowledge base in this area of research. Most significantly, this is the first study trying to address the #3 question. Although the data is not conclusive yet, this is a very good beginning, and we are looking forward to more in-depth study from the team in the years to come.”
“The new genomes of horseshoe bats that you generated are a major contribution in their own right, but your discovery of extensive chromosomal rearrangements that seem to be linked to enhanced adaptive evolution of immunity-related genes is truly groundbreaking.” Says Dr. Nancy B. Simmons, the curator-in-charge of Department of Mammalogy at American Museum of Natural History, a world-leading expert in bat biology. “I think that discoveries like these will pave the way for better understanding of why and how horseshoe bats are such competent natural hosts of zoonotic viruses like those related to SARS-CoV-2.”